

Echinocandine sind eine neue Substanzgruppe, die einen wesentlichen Beitrag zur effektiven antimykotischen Therapie schwer kranker Patienten mit Pilzinfektionen leisten kann. Derzeit sind mit Anidulafungin, Caspofungin und Micafungin drei Vertreter in Deutschland zugelassen.
Echinocandine sind semisynthetische Lipopetide, ihre Grundstruktur ist ein zyklisches Hexapeptid. Sie zeigen eine antimykotische Aktivität, die auf der Hemmung eines Schlüsselenzyms der Zellwandsynthese von Pilzen beruht. Natürliche Lipopeptide können aus verschiedenen Pilzarten isoliert werden. Ihre Wirkung ist bereits seit Anfang 1970 bekannt. Cilofungin war die erste Substanz, die in klinischen Studien eingesetzt wurde.
Natürliche Lipopetide
| Lipopeptid | Pilz |
| Aculeacin A | Aspergillus aculeatus |
| Echinocandin B | Aspergillus rugulovalvus |
| Pneumocandin B | Zalerion arboricola |
| Enfumafungin | Hormonema-like fungus |
| Papulacandin | Papularia sphaerosperma |
Anidulafingin Caspofungin Micafungin
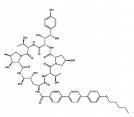
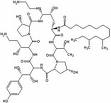
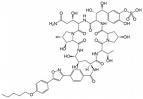 Die natürlichen Lipopetide, wie auch das Cilofungin, haben ungünstige physikalisch-chemische und pharmakologische Eigenschaften bei systemischer Anwendung. Zu den unerwünschten Arzneimittelwirkungen zählen vor allem Schädigungen des Venenendothels, Gewebsnekrosen oder toxische Effekte am Applikationsort. Durch die semisynthetische Einführung saurer oder basischer Gruppen in das Molekülgerüst und Änderungen an der natürlichen aliphatischen Seitenkettensäure beispielsweise durch aromatische Acylkomponenten konnten diese Eigenschaften deutlich verbessert werden. Insbesondere der Abwandlung der Fettsäureseitenkette kommt zentrale Bedeutung bei Partialsynthesen von Lipopeptiden zu, wobei als Ausgangsprodukt heute meist Echinocandin B, Pneumocandin A0 oder B0 eingesetzt wird.
Die natürlichen Lipopetide, wie auch das Cilofungin, haben ungünstige physikalisch-chemische und pharmakologische Eigenschaften bei systemischer Anwendung. Zu den unerwünschten Arzneimittelwirkungen zählen vor allem Schädigungen des Venenendothels, Gewebsnekrosen oder toxische Effekte am Applikationsort. Durch die semisynthetische Einführung saurer oder basischer Gruppen in das Molekülgerüst und Änderungen an der natürlichen aliphatischen Seitenkettensäure beispielsweise durch aromatische Acylkomponenten konnten diese Eigenschaften deutlich verbessert werden. Insbesondere der Abwandlung der Fettsäureseitenkette kommt zentrale Bedeutung bei Partialsynthesen von Lipopeptiden zu, wobei als Ausgangsprodukt heute meist Echinocandin B, Pneumocandin A0 oder B0 eingesetzt wird.
Von den drei bekannten Echinocandinen liegt Caspofungin als Acetat, Micafungin als Natriumsalz und Anidulafungin als freie Base vor. Zielstrukturen der Echinocandine liegen innerhalb der Pilzzelle. Die Lipophilie ist daher ein wesentliches Wirksamkeitsmerkmal und für Anidulafungin am ausgeprägtesten.
Die Zellhülle der Pilze besteht aus einer an das Zytoplasma grenzenden Plasmamembran, der Zellwand und dem dazwischen liegenden periplasmatischen Raum. Wesentliche Bausteine (ca. 90%) der starren Zellwand vieler Pilze sind Polysaccharide wie Chitin, Glucane und Mannane. Die Kohlenhydratpolymere der Glucane (1,3-Beta-Glucanfibrillen, 1,6-Beta-Glucanfibrillen) bilden ein Netzwerk, das Struktur und Festigkeit verleiht und einem Aufblähen der Zellmembran bedingt durch hohe intra- und extrazelluläre osmotische Druckdifferenzen entgegenwirkt [12]. Während 1,3-Beta- Glucanfibrillen vor allem plasmamembrannah organisiert sind, verknüpfen 1,6-Beta-Glucanfibrillen verschiedene Komponenten der Zellwand. Störungen im Zellwandgefüge führen zum Absterben der Pilzzelle. Eine Wirkung der Echinocandine tritt bereits bei suboptimalen Konzentrationen ein. Ursächlich für diesen Effekt ist möglicherweise ein Einfluss auf weitere Zellwandbausteine, die mit den Glukanen in Zusammenhang stehen. Hierzu zählt die Enolase, die essenzielle enzymatische Aufgaben beim Zellwandaufbau hat und antigene Eigenschaften besitzt.
Humane Zellen unterscheiden sich in ihrem Zellwandaufbau von der Pilzzelle, Glucane kommen nicht vor. Daher ist die Synthese dieser Pilzzellwandbausteine ein selektives Target für die antimykotische Therapie. Echinocandine hemmen den membranständigen 1,3- Beta-D-Glucan-Synthetase-Komplex, der, soweit bekannt, aus einem großen intra- und transmembranären Protein FKS und einer kleinen regulatorischen Untereinheit Rho1p besteht. Die Untereinheiten sind alleine inaktiv. FKS bindet das Substrat UDP-Glukose, das zu linearen Glucan-Fibrillen polymerisiert wird. In Sprosspilzen wurden zwei FKS-Homologe FKS1p und FKS2p, die auf verschiedenen Genen kodiert sind, isoliert. Das FKS1-Gen wird während der normalen vegetativen Wachstumsphase exprimiert, FKS2 vor allem während der Sporulation. In Aspergillen und Kryptokokken konnte bisher nur ein FKS-Gen gefunden werden.
Die Funktionsfähigkeit des 1,3-Beta-D-Glucan-Enzym-Komplexes ist für die Pilzzelle lebensnotwendig. Die Hemmung führt bei Sprosspilzen zur Lyse der Pilzzelle. Echinocandine zeigen somit bei Candida spp. einen fungiziden Effekt. Der 1,3-Beta-D-Glucan-Synthetase Komplex ist bei Aspergillen nur an den Hyphenspitzen und an den Verzweigungspunkten lokalisiert. Echinocandine induzieren morphologische mikroskopisch sichtbare Veränderungen der Hyphen und bewirken hier einen fungistatischen Effekt.
Das Wirkspektrum der Echinocandine umfasst klinisch relevante Aspergillen, Candida-Arten und Pneumocystis jiroveci. Weitgehend unempfindlich gegenüber Echinocandinen sind Kryptokokken, Trichosporon spp., Zygomyzeten und Fusarien. Es besteht keine Kreuzresistenz zu Azol-Derivaten und Polyenen.
Echinocandine wirken bei C. albicans, C. glabrata, C. tropicalis, C. dubliniensis und C. krusei bereits bei niedrigen Wirkstoffkonzentrationen. Weniger aktiv sind die Echinocandine bei C. parapsilosis und C. guilliermondii. Die MHK-Werte von Caspofungin liegen generell höher als vergleichbare Werte für Anidulafungin und Micafungin.
Eine direkte Gegenüberstellung der MHK-Werte ist jedoch nur sinnvoll, wenn die Ergebnisse methodengleich erzielt wurden. Einen deutlichen Einfluss auf die in-vitro Testergebnisse hat u.a. die Zugabe von Serum zum Testmedium.
Zusammenhänge zwischen in-vitro Aktivität und in-vivo Wirkung sind noch wenig belegt. Allerdings korrelieren höhere MHK-Werte mit einem ungünstigeren therapeutischen Erfolg. So zeigt C. parapsilosis bei allen Echinocandinen tendenziell erhöhte MHK-Werte und niedrige Heilungsquoten.
Echinocandine sind aktiv gegenüber A. fumigatus, A. niger und A. flavus, A. nidulans, A. terreus und A. candidus. Echinocandine bewirken mikroskopisch sichtbare morphologische Veränderungen der Hyphen. Die Aktivität ist abhängig von dem Erreichen einer Grenzwertkonzentration, die als minimale effektive Konzentration (MEK-Wert) bezeichnet wird. Eine vergleichende Beurteilung von MEK-Werten ist nicht einfach und vergleichende Daten zu den drei Echinocandine sind rar.
In einer kürzlich publizierten Untersuchung zur Pharmakodynamik von Echinocandinen bei nicht gekeimten und gekeimten Konidien verschiedener Aspergillen lagen die MEK-Werte bei nicht gekeimten und gekeimten Konidien für Anidulafungin und Micafungin niedriger als für Caspofungin.
Substanzspezifische Unterschiede lassen sich in den MHK-Werten und gelegentlich auftretenden abnehmenden Empfindlichkeiten beobachten. Die Beurteilung von Resistenzen ist für Echinocandine schwierig, da für die Empfindlichkeitstestung bei Candida spp. und Aspergillen allgemein akzeptierte Labormethoden und klinisch interpretierbare Breakpoints fehlen. Die ermittelten MHK sind abhängig von der Art des verwendeten Mediums, der Inkubationszeit und dem Ablesezeitpunkt. Die hohe Variabilität der Isolate, die auch bei gleicher Spezies auftreten können, und das abweichende Wachstumsverhalten in vivo erlauben keine zuverlässige Auskunft zur therapeutischen Aktivität.
Eine Resistenz gegenüber Echinocandinen ist, soweit beurteilbar, ein eher seltenes Ereignis, dessen Ursachen veränderte Zielenzyme durch Mutation des FKS1 Enzymkomplexes, der Überexpression von Transportproteinen (Sbe2P) oder effektive Effluxpumpen sein können. Isolate von C. albicans, C. parapsilosis, C. glabrata, C. krusei mit verminderter Empfindlichkeit sind beschrieben, eine vollständige Kreuzresistenz der Echinocandine besteht jedoch nicht.
Candida-Arten zeigen eine Adhärenz zu Kunststoffoberflächen, beispielsweise von dauerhaften Urin- und Venenkathetern, Endotrachaltuben, künstlichen Herzklappen, Schrittmachern und Gelenkersatz. Sie bilden Biofilme aus, die ein Reservoir für potenzielle systemische Candida-Infektionen darstellen. Bei etwa der Hälfte aller nosokomial erworbenen Candida-Infektionen können diese Biofilme nachgewiesen werden. Sessile Erreger zeigen ein vom planktonischen Wachstum abweichendes Verhalten durch unterschiedliche Genexpression. Sie besitzen die Fähigkeit, von der Sprossform in die Fadenform mit Hyphen oder Pseudohyphen zu wechseln. Faktoren, die diese morphologische Änderung bewirken können, sind erhöhte Temperaturen, pH-Wert Änderungen und Mangelzustände. Im Zusammenspiel weiterer bisher nicht vollständig bekannter Faktoren zeigen sessile Candida spp. eine hohe Virulenz und ein verändertes Resistenzverhalten gegenüber vielen Antimykotika.
Nach den gültigen Empfehlungen der Fachgesellschaften sollen besiedelte Fremdkörper entfernt werden. Im Gegensatz zu Azolen sind die Echinocandine auch gegen biofilmbildende Candida-Arten wirksam, wobei erreger- und substanzspezifische Unterschiede in der Aktivität beobachtet werden. Caspofungin und Micafungin haben eine gute Aktivität gegenüber sessilen C. albicans und C. glabrata und eine geringe Aktivität gegenüber C. parapsilosis und C. krusei. Anidulafungin zeigte eine gute Wirksamkeit gegenüber C. albicans [28]. Es liegen Hinweise für eine Wirksamkeit bei NAC Biofilm-produzierenden Arten vor.
Echinocandine werden nur in geringem Umfang resorbiert und müssen daher parenteral appliziert werden. Die Proteinbindung ist bei allen Vertretern dieser Substanzklasse hoch (97-99%). Die Pharmakokinetik ist bei Micafungin und Anidulafungin im therapeutischen Bereich linear. Caspofungin weist eine leicht nicht lineare Pharmakokinetik mit einer zunehmenden Akkumulation bei Dosissteigerungen auf [18].
Echinocandine zeigen nach intravenöser Gabe eine gute Verteilung in das Gewebe (Lunge, Leber, Intestinum, Milz, Niere), wie Daten aus Untersuchungen beim Menschen und Tierversuchen zeigen. Anidulafungin penetriert auch in das ZNS. Das Verteilungsvolumen ist abhängig von der Lipophilie der Substanz und beträgt 0,6 l/g Körpergewicht für Anidulafungin, etwa 0,15 l/kg Körpergewicht für Caspofungin und 0,4 l/kg Körpergewicht für Micafungin. Das Verteilungsvolumen für Caspofungin kann laut der Fachinformation nicht oder nur ungenau ermittelt werden, da die Elimination bereits vor dem Erreichen eines Verteilungsgleichgewichts einsetzt. Dies ist vermutlich auch für Micafungin gültig, da es sich nur sehr langsam im Körper verteilt.
Eliminations- und Metabolisierungswege der Echinocandine differieren voneinander und sind der Grund für unterschiedliche Empfehlungen zu Dosierungen bei Organinsuffizienzen und bei potenziellen Interaktionen mit Komedikamenten.
Anidulafungin wird durch eine chemische Ringöffnung im Serum inaktiviert und anschließend durch unspezifische Peptidasen abgebaut. Die Abbauprodukte sind inaktiv. Es erfolgt keine Metabolisierung. Die Elimination erfolgt hauptsächlich fäkal (30 % Abbauprodukte, < 10 % unverändert) und nur zu einem geringen Teil renal (< 1 % unverändert). Die Halbwertszeit beträgt 24-40 Stunden bei Erwachsenen und 13-36 Stunden bei Kindern.
Bei Caspofungin erfolgt zunächst eine N-Acetylierung und spontane Hydrolyse des Hexapeptid-Ringes. In geringem Umfang unterliegt Caspofungin einer spontanen Degradation. Zwei Zwischenprodukte, die während dieses Abbaus entstehen, bilden kovalente Addukte an Plasmaproteine. Zu einem geringen Anteil sind diese Bindungen irreversibel. Caspofungin wird in geringem Umfang über Cytochrom P 450 Enzyme hepatisch metabolisiert. Die Elimination erfolgt renal ( < 2 % unverändert, 40 % Metabolite), fäkal (ca. 35 % Metabolite) und zu einem geringen Anteil auch biliär (< 1%). Die Halbwertszeit beträgt 9-11 Stunden bei Erwachsenen und 8-11 Stunden bei Kindern.
Micafungin wird durch die hepatische Arylsulfatase und Catechol-O-Methyltransferase metabolisiert. Drei Metabolite M1, M2 und M5 konnten nachgewiesen werden, wobei die Umwandlung in M1 und M2 zu M5 in geringem Umfang durch CYP3A4 katalysiert wird. Die Elimination erfolgt im wesentlichen biliär (90 % Metabolite) und in geringem Umfang auch renal (< 1% unverändert, 10 % Metabolite). Die Halbwertszeit für Micafungin beträgt 13-15 Stunden, bei Kindern 11-13 Stunden.
Keines der Echinocandine ist ein Substrat des P-Glykoproteins.
Pharmakokinetische Parameter der Echinocandine
| Anidulafungin | Caspofungin | Micafungin | |
| Cmax | 7,2 µg/ml | 9,9 µg/ml | 10,1 µg/ml |
| Proteinbindung | 99 % | 97 % | 99 % |
| Vd rel | 0,6 l/kg KG | 0,15 l/kg KG | 0,4 l/kg KG |
| Halbwertszeit | 24-40 h | 9-11 h | 13-15 h |
| Metabolisierung | Nicht hepatisch | Hepatisch | Hepatisch |
| Spontane Degradation Unspezifische Peptidasen | Hydrolyse N-Acetylierung Spontane Degradation | Arylsulfatase Catchol-O-Methyltransferase | |
| Elimination | |||
| Renal | < 1 % unverändert | 2 % unverändert 40 % Metabolite | < 1 % unverändert |
| Fäzes | 30 % | 35 % | 40 % |
Auf Grund der günstigen Pharmakokinetik ist bei den Echinocandinen mit einem geringen Interaktionspotenzial zu rechen.
Die am besten untersuchte Substanz ist Caspofungin. In der Kombination mit Ciclosporin zeigt sich ein klinisch relevanter Effekt und erfordert wegen einer erhöhten Clearance von Caspofungin die Do-sisanpassung von 50 auf 70 mg pro Tag. Bei gleichzeitiger Anwendung von Caspofungin mit den In-duktoren von Stoffwechselenzymen wie Efavirenz, Nevirapin, Rifampicin, Dexamethason, Phenytoin oder Carbamazepin kann die AUC von Caspofungin verringert werden. In diesen Fällen sollte erwogen werden, die Tagesdosis auf 70 mg zu erhöhen. Klinische Studien mit gesunden Probanden zeigen, dass die Pharmakokinetik von Caspofungin durch Itraconazol, Amphotericin B, Mycophenolat, Nelfinavir oder Tacrolimus nicht in klinisch relevantem Ausmaß verändert wird. Bei gleichzeitiger Anwen-dung von Caspofungin und Tacrolimus werden jedoch die Plasmakonzentrationen von Tacrolimus erniedrigt. Dies erfordert eine Dosisanpassung von Tacrolimus.
Bei Micafungin sollten Patienten, die eine Kombinationstherapie mit Itraconazol, Nifedipin und Siro-limus erhalten, wegen ansteigender Serumspiegel dieser Medikamente auf Anzeichen einer Überdosie-rung beobachtet werden. Gegebenenfalls muss die Dosis reduziert werden [17]. Die Pharmakokinetik von Micafungin wird bei gleichzeitiger Anwendung mit Mycophenolatmofetil, Ciclosporin, Tacrolimus, Prednisolon, Sirolimus, Nifedipin, Fluconazol, Ritonavir, Rifampicin, Itraconazol, Voriconazol oder Amphotericin B nicht verändert.
Während bei Anidulafungin seit der Markteinführung in den USA im Jahr 2005 bisher keine klinische relevanten Interaktionen bekannt sind, sollten für Micafungin Untersuchungen zur Unbedenklichkeit in der Kombination mit potenten Substraten insbesondere von CYP3A4 durchgeführt werden. Von Interesse sind hierbei neben den Immunsuppressiva und die Protease-Inhibitoren zur antiretroviralen Therapie.
Tabelle 8. Bekannte Wechselwirkungen der Echinocandine mit anderen Medikamenten
| Anidulafungin | Caspofungin | Micafungin | |
| P-Glykoprotein | - | - | - |
| Substrat CYP450 | - | + | CYP3A |
| Inhibitor CYP450 | - | - | CYP3A |
| Induktor CYP450 | - | - | - |
| Komedikation | |||
| Amphotericin B/liposomal | - | - | |
| Carbamazepin | + | ||
| Ciclosporin | + | + | - |
| Dexamethason | + | ||
| Efavirenz | + | ||
| Fluconazol | - | ||
| Itraconazol | - | + | |
| Mycophenolat | - | - | |
| Nelfinavir | + | ||
| Nevirapin | + | ||
| Nifedipin | + | ||
| Phenytoin | + | ||
| Prednisolon | - | ||
| Rifampicin | - | + | |
| Ritonavir | |||
| Sirolimus | + | ||
| Tacrolimus | - | + | - |
| Voriconazol | - |
Ziel der antimykotischen Behandlung mit Echinocandinen ist das Erreichen eines möglichst dauerhaften und hohen Wirkspiegels oberhalb der MHK der Erreger. Die Aktivität nimmt in der Regel mit steigenden Konzentrationen der Wirkstoffe zu und kann durch einen hohen AUC/MHK-Quotienten ausgedrückt werden.
Ein paradoxer Effekt (Eagle-Effekt) mit weiterem Wachstum der Erreger und Zellvermehrung bei erhöhten Wirkstoffkonzentrationen wurde für Sprosspilze und Aspergillen beschrieben. Er tritt unter Caspofungin häufiger auf als unter Anidulafungin oder Micafungin. Als Ursache hierfür wird eine vermehrte Bildung von Chitin oder eine Derepression von Resistenzmechanismen diskutiert. Die klinische Relevanz ist noch nicht abschließend beurteilt.
Echinocandine zeigen einen postantifungalen Effekt, der abhängig vom Erreger ist. Er dauert bei den meisten Candida spp. bis zu 12 Stunden an, bei Aspergillen ist er deutlich geringer ausgeprägt. Nach Exposition mit Caspofungin oder Micafungin wurde in A. niger Kulturen ein postantibiotischer Effekt von weniger als einer halben Stunde beobachtet.
Caspofungin und Anidulafungin sind in Deutschland zur Behandlung von invasiven Candida-Infektionen bei Erwachsenen zugelassen. In der Behandlung von Aspergillosen ist von den Echinocandinen derzeit nur der Einsatz von Caspofungin in der Sekundärtherapie oder in der empirischen Therapie bei Verdacht auf Pilzinfektionen (Sproßpilze oder Aspergillen) bei Patienten mit Neutropenie möglich. In den USA kann Anidulafungin auch bei Ösophagus-Candidosen eingesetzt werden. Micafungin wurde im Herbst 2008 in Deutschland zur Behandlung invasiver Candida-Infektionen, zur Prophylaxe von Candida-Infektionen bei Patienten, die sich einer Knochenmarktransplantation unterziehen, und zur Behandlung von Candidosen im Ösophagus zugelassen. Wegen des Risikos hepatozellulärer Tumore unter einer Micafungin Behandlung, empfiehlt die EMEA, Micafungin nur bei Unverträglichkeiten oder unzureichender Wirksamkeit anderer Antimykotika einzusetzen.
Micafungin und Caspofungin sind auch zur antimykotischen Therapie bei Kindern und Säuglingen zugelassen. Anidulafungin hat keine Zulassung in diesen Altersgruppen, doch liegen Daten aus Studien zur Sicherheit und Dosierung in der Pädiatrie vor.
Für alle Echinocandine sind zahlreiche Studien angemeldet (www.clinicaltrials.gov), so dass zukünftig mit weiteren Zulassungen speziell im Bereich der Pädiatrie und bei Patienten mit Neutropenie zu rechnen ist.
Verschiedene Vorsichtsmaßnahmen schränken die therapeutischen Möglichkeiten der Echinocandine bei Leberfunktionsstörungen, Nierenfunktionsstörungen, Hämolyse oder Anämie (nur Micafungin), sowie bei Komedikationen (nur Caspofungin und Micafungin) ein. Es bestehen jedoch keine Kontraindikationen.
Der Gehalt an Fruktose bzw. Sucrose von Anidulafungin bzw. Caspofungin muss bei hereditären Fruktose-Intolaranz berücksichtigt werden. Zubereitungen von Anidulafungin enthalten pro 100 mg Substanz 6 g Ethanol, daher besteht ein Warnhinweis für die Anwendung bei Alkoholikern und Patienten mit Anfallsleiden. 6 g Ethanol verursachen einen Blutethanolgehalt von 0,1 0/00, der innerhalb von einer Stunde abgebaut wird und daher in der Regel zu vernachlässigen ist.
Die Normaldosierung von Anidulafungin beträgt bei invasiven Candidosen im Erwachsenenalter initial 200 mg gefolgt von 100 mg täglich. Durch die hohe anfängliche Dosis wird ein steady state Gleichgewicht bereits am ersten Tag erreicht. Bei Leberinsuffizienz, Niereninsuffizienz, im Alter, bei Übergewicht und bei Komedikationen sind keine Anpassungen notwendig.
Caspofungin wird am ersten Tag mit 70 mg dosiert, an folgenden Tagen mit 50 mg/Tag. Ein steady state Gleichgewicht wird damit am 2. Tag erreicht. In Deutschland wird bei Patienten mit Gewicht > 80 kg empfohlen, die Initialdosierung beizubehalten. Die amerikanische Zulassung sieht diese Anpassung nicht vor. Bei Nierensuffizienz und Leberinsuffizienz bis zum Child Pugh 5-6 müssen keine Dosisanpassungen vorgenommen werden, ab Child Pugh 7-9 ist eine Dosisreduktion auf 35 mg/Tag notwendig. Bei schwerer Einschränkung der Leberfunktionsleistung sollte Caspofungin nicht eingesetzt werden. Bei älteren Patienten ist die AUC um etwa 30 % vergrößert, eine Dosisreduktion jedoch nicht notwendig.
Ebenso wie die anderen Substanzen kann Micafungin bei Niereninsuffizienz ohne Dosisalteration verabfolgt werden. Für die Dosierung bei Leberinsuffizienz Child Pugh > 9 liegen keine Daten vor, die Gabe von Micafungin in dieser Situation ist nicht empfohlen.
Die zugelassenen semisynthetischen Echinocandine zeichnen sich durch eine gute Verträglichkeit aus. Schwere unerwünschte Arzneimittelwirkungen, die zu einem Therapieabbruch führen, kommen eher selten vor. Hierzu zählen vor allem Leberfunktionsstörungen, Fieber, Schüttelfrost und Hautreaktionen. Histamin-induzierte Reaktionen lassen sich bei Echinocandinen durch eine langsame Infusion reduzieren. Häufigste therapieassoziierten Nebenwirkungen sind gastrointestinale Störungen mit Übelkeit, Erbrechen und Oberbauchbeschwerden, Phlebits und lokale Beschwerden am Applikationsort. Substanzspezifische Unterschiede, bedingt durch Variationen der lipophilen Fettsäureseitenkette, sind zu beachten. Die Inzidenz einiger Nebenwirkungen war bei Kindern für Micafungin höher als bei Erwachsenen .
Für Micafungin wurden nach einer Behandlungsperiode von = 3 Monaten bei Ratten hepatozelluläre Tumore beobachtet. Der vermutliche Schwellenwert für die Tumorentwicklung befand sich im therapeutischen Bereich. Während der Behandlung mit Micafungin muss daher die Leberfunktion engmaschig kontrolliert werden und eine sorgfältigen Nutzen-Risiko-Bewertung erfolgen. Langzeituntersuchungen zur Klärung des kanzerogenen Potenzials von Caspofungin und Anidulafungin in therapeutischen Dosierungen wurden nicht durchgeführt. In toxikologischen Untersuchungen, die z.T. über 3 Monate verliefen, fanden sich keine Hinweise.
Häufige unerwünschte Arzneimittelwirkungen der Echinocandine [41,3]
| Unerwünschte Arzneimittelwirkungen | Anidulafungin | Caspofungin | Micafungin |
| Histamin-induzierte, dermatologische und andere Effekte | |||
| Phlebitis | < 1 | 3,5-25 | 1,6 |
| Fieber | < 1 | 4-40 | 1-14 |
| Hautausschlag/Pruritus | 1; <2 | 1-10; <2 | 1-12; <1 |
| Gastrointestinale und hepatische Effekte | |||
| Bauchschmerz | < 2 | 3,6 | 1 |
| Übelkeit/Erbrechen | 1; <1 | 1-6; 2-4 | 2-7; 1-5 |
| Durchfall | 3,1 | 3,6 | 1,6 |
| Erhöhte Leberfunktionswerte | 3-5 | 1-15 | 1-8 |
| ZNS | |||
| Kopfschmerz | 1,3 | 4-15 | 2-17 |
| Hämatologische Effekte | |||
| Leukopenie | < 1 | 6,2 | 1,6 |
| Neutropenie | 1 | 1,9 | 1,2 |
| Thrombozytopenie | < 2 | 3,1 | <1 |
| Endokrinologische/metabolische Effekte | |||
| Hyokaliämie | 3-10 | 2-10 | 1,2 |
Echinocandine bilden eine neue Substanzklasse zur antimykotischen Therapie. Sie haben in klinischen Studien gute Wirksamkeit und ein insgesamt günstiges Nebenwirkungsprofil belegen können. Dosisanpassungen bei Organinsuffizienzen sind nur in geringem Umfang bzw. bei Anidulafungin gar nicht notwendig. Ein Interaktionspotenzial mit anderen Medikamenten ist nur in geringem Ausmaß vorhanden. Echinocandine haben daher einen hohen Stellenwert in der Behandlung invasiver Pilzinfektionen insbesondere durch Candida spp., wobei substanzspezifische Unterschiede berücksichtigt werden müssen. Von besonderem Vorteil ist die Wirksamkeit der Echinocandine bei biofilmbildenden Candida spp.
Die Empfehlung der EMEA, Micafungin nur bei Unwirksamkeit oder Unverträglichkeit anderer Antimykotika zu verwenden, wird die Einsatzmöglichkeit dieser Substanz stark einschränken. Caspofungin kann bei Infektionen durch Candida spp oder Aspergillen einschließlich Patienten mit Neutropenie therapeutisch genutzt werden und besitzt von allen Echinocandinen damit das breiteste Anwendungsspektrum. Demgegenüber konnte mit Anidulafungin erstmalig eine signifikante Überlegenheit in der Behandlung von invasiven Candida-Infektionen insbesondere bei C. albicans gegenüber einem Standardtherapeutikum (Fluconazol, Amphotericin B) gezeigt werden. Zudem ist die Verträglichkeit von Anidulafungin im Vergleich zu Caspofungin hinsichtlich histamininduzierter und lokaler Reaktionen sowie dem Anstieg von Leberfunktionswerten nach bisherigen Daten nochmals verbessert.
Die Neufassung der Empfehlungen der IDSA-Guideline zur gezielten oder empirischen Behandlung von Candidämien werden den Einsatz der Echinocandine vorsehen. Sie sind zu bevorzugen bei Infektionen durch unbekannte Candida spezies, bei Patienten mit moderater bis schwerer Erkrankung oder einer vorausgegangenen Therapie mit einem Azol, sowie bei Nachweis von C. krusei und C. glabrata. Bei nachgewiesener oder vermuteter Infektion durch C. parapsilosis ist ein Azol (Fluconazol) vorzuziehen. Bei nicht neutropenischen Patienten, die mit einem Echinocandin anbehandelt wurden und klinisch stabil sind, kann die Therapie fortgeführt werde´n. Zur Frage, welches der Echinocandine zu bevorzugen ist, sind direkte Echinocandin-Vergleichsstudien notwendig.
Derzeit sind die Tagestherapiekosten aller zugelassenen Substanzen dieser Gruppe hoch und liegen in der Größenordnung liposomaler Zubereitungen von Amphotericin B. Zusatzentgeltregelung und NuB-Leistungen sind zu beachten. Im Jahr 2009 gelten für Caspofungin weiterhin Zusatzentgeltregelungen, für Anidulafungin und Micafungin können Anträge für neue Untersuchungs- und Behandlungsmethoden beim INEK eingereicht werden.
Wie bei allen kurativen Therapieansätzen sind diese direkten Kosten jedoch nicht das entscheidende Kriterium für den rationalen Einsatz. Ein frühzeitige eingeleitete Therapie mit potenten Antimykotika verringert die Letalität und kann zu einer Minimierung der Gesamttherapiekosten durch eine geringere Verweildauer führen. Angesichts der geschätzten jährlichen Kosten von mehr als $10 Milliarden Dollar durch systemische Candida-Infektionen in den USA ergibt sich ein hohes Einsparpotenzial.